其中,Li和Fe任意排列但在原子晶格中共享相同的位置,(Li,Fe)和Ch一起構成了緊密堆積的立方體,O2−占據八面體空穴位置。充放電過程中,Li+以三維路徑進行遷移。這種材料與商業化的LiCoO2相比,成本可以降低95%。
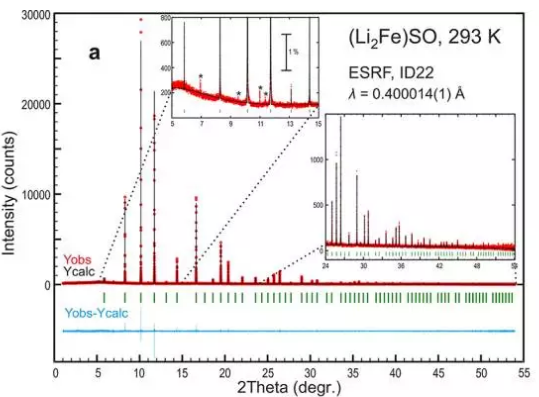
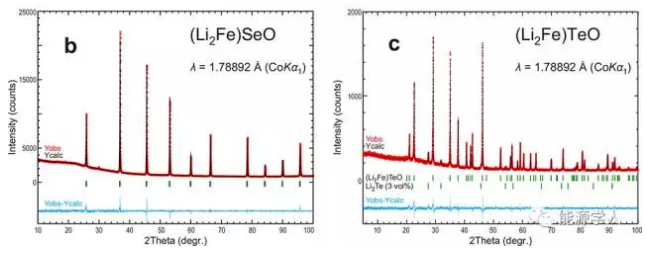
圖1. (a) (Li2Fe)SO的同步輻射X射線衍射圖譜,(Li2Fe)SeO (b)和(Li2Fe)TeO(c)的粉末照相X射線衍射圖譜。
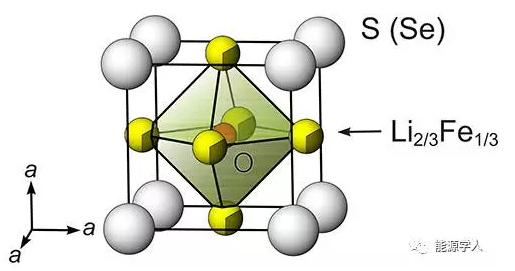
圖2.立方體反鈣鈦礦結果(Li2Fe)ChO (Ch= S, Se)的晶體結構示意圖。
(Li2Fe)ChO(Ch = S, Se)具有良好的熱穩定性。當加熱到1000℃,(Li2Fe)SeO未發生相變;即使到1250℃,熔融再結晶后的(Li2Fe)SeO也僅僅只有微量雜相產生。類似的情況同樣發生在(Li2Fe)SO上。雖然這些材料“不懼”高溫,但是卻怕水和氧。在濕空氣中,(Li2Fe)SeO 會發生如下反應:
(Li2Fe)SeO+ 3x/2 H2O + x/4 O2 →(Li2−xFe)SeO + x Li(OH)(H2O)
(Li2Fe)SO則更為嚴重。因此,這種材料制備過程中必須盡量隔絕水和氧才能提高產率,防止結構的破壞。

圖3.在氬氣氛圍中,(Li2Fe)SeO的差熱分析和熱重分析圖。
當(Li2Fe)SeO作為鋰離子電池正極材料,石墨作為對電極時,充電反應如下:
(Li2Fe)SeO+ nC(石墨) → (Li2-xFe)SeO+LixCn
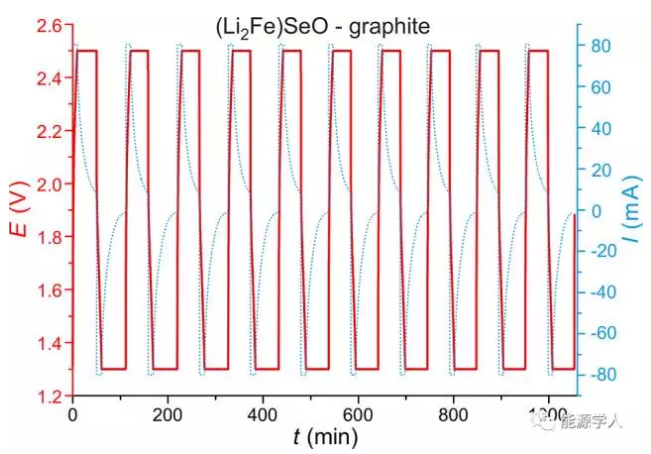
圖4.(Li2Fe)SeO-石墨電池的十次充放電曲線。
如果上述公式中x=1,則1mol的(Li2Fe)SeO會脫出1mol的Li,產物為(LiFe)SeO。根據公式計算得出(Li2Fe)SeO 的理論比容量為162.8mAh/g;基于相同的計算,(Li2Fe)SO的理論比容量為227 mAh/g。
實際測試過程中,在30 mA/g(0.25C)的倍率條件下,(Li2Fe)SeO的實際比容量為120 mAh/g,是其理論容量的3/4。值得注意的是,這種材料的體積在脫鋰后并未發生明顯變化,晶格應力可忽略。
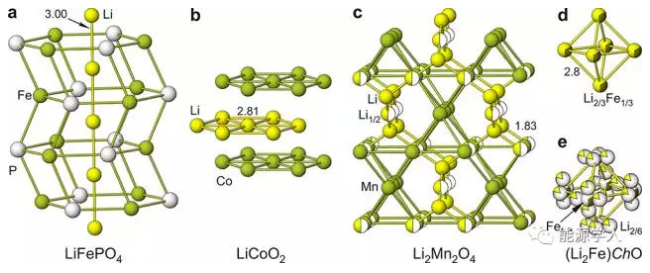
圖5.Li+在橄欖石型LiFePO4,銅鐵礦型LiCoO2,尖晶石型Li2Mn2O4,反鈣鈦礦型(Li2Fe)ChO(Ch = S, Se)以及具有Li分離位置的反鈣鈦礦型(Li2Fe)SeO中的遷移路徑。
基于以上反鈣鈦礦材料的研究,通過改變(Li□Fe)ChO (□ = vacancy, Ch = S, Se)中空穴含量和Ch元素種類,有可能得到無明顯應力變化的更高容正極材料,以突破正極材料容量低、循環穩定性差的瓶頸。
另外,作者在文中還提到這種材料用在全固態電池中極具優勢,這也是值得去探究的。不過該材料的電位平臺與其他正極材料相比較低,是需要去進一步改善的地方之一。






